주기율표의 많은 화학 원소는 결합하여 화합물을 형성 할 수있다. 그러나 모든 요소가 동일한 방식으로 결합되는 것은 아닙니다. 결합하여 형성되는 화합물을 작성하기 전에 각 요소의 개별 특성을 고려해야합니다. 가장 일반적인 유형의 화합물은 금속 화합물, 이온 성 화합물 및 공유 화합물이다. 유기 화합물과 무기 화합물 사이에도 차이가 있습니다. 화학 화합물은 화학의 기본 구성 요소이기 때문에 원소를 결합하여 화합물을 형성하는 방법을 아는 것이 유용합니다.
금속, 비금속 및 메탈 로이드를 구별하십시오. 금속은 일반적으로 주기율표의 왼쪽과 중앙에 있습니다. 그들은 좋은 전기 지휘자입니다. 구리가 한 예입니다. 메탈 로이드는 붕소, 실리콘, 제라늄, 비소, 안티몬, 텔 루륨 및 폴로늄으로 구성됩니다. 그들은 금속과 비금속의 특성을 가지고 있습니다. 비금속은 수소를 제외하고 주기율표의 오른쪽에 있습니다. 비금속은 가스 또는 부서지기 쉬운 고체입니다. 그들은 전기를 잘 전도하지 않습니다. 예는 질소입니다.
금속이 금속 결합을 형성하는 방법을 이해합니다. 금속 결합은 동일한 금속의 원소가 결합 할 때 발생하는 전자의 자유로운 움직임을 나타냅니다. 아연이 예입니다.
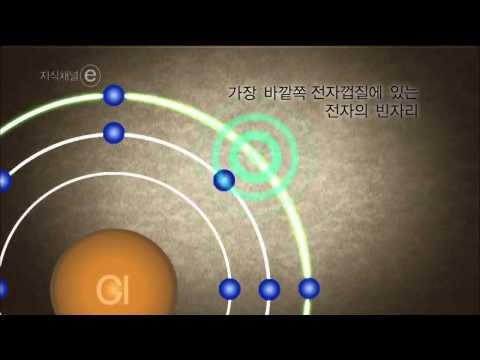
전기 음성도가 높은 요소를 확인하십시오. 그룹 17의 원소는 전기 음성도가 높으며, 이는 결합이 형성 될 때 다른 원소의 전자를 끌어 당기는 것이 바람직하다. 그 이유는 그룹 17의 원소가 7 개의 원자가 전자를 갖기 때문입니다. 그러므로, 옥텟을 완성하기 위해서는 하나의 전자 만이 필요하다.
전기 음성도가 낮은 요소를 확인하십시오. 그룹 1의 원소는 원자가 껍질에 전자가 하나만 있기 때문에 전기 음성도가 가장 낮습니다.
비금속 원소와 금속 원소의 조합을 분석합니다. 금속과 비금속을 결합한 결과는 이온 결합입니다. 이온 결합에서 전자가 전달됩니다. 많은 비금속은 전기 음성도가 높고, 그룹 1 및 2의 금속은 전기 음성도가 매우 낮기 때문에 이러한 원소가 결합하여 이온 결합을 형성합니다. 예는 염화칼륨 또는 KCl입니다.
비금속의 조합을 분석하십시오. 비금속 인 둘 이상의 원소를 결합하면 전자가 전달되지 않습니다. 대신, 전자가 공유 될 것이며, 이는 공유 결합에서 발생합니다. 공유 결합의 예는 NO2 또는 이산화질소이다.
유기 화합물과 무기 화합물을 구별하십시오. 유기 화합물은 탄소를 함유하고 무기 화합물은 함유하지 않습니다. 예를 들어, CH4는 유기 화합물의 예이고, MgBr2는 무기 화합물의 예이다.