콘텐츠
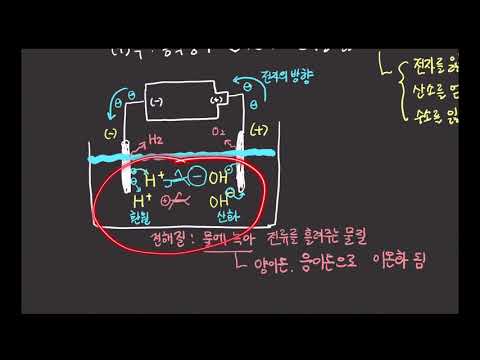
전기 분해는 전류를 사용하여 화학 반응을 유도하는 과정입니다. 문제의 화학 반응은 전형적으로 원자가 전자를 교환하고 산화 상태를 변화시키는 환원-산화 반응이다. 이 공정은 금속 고형물을 생성하는데 사용될 수 있으며, 이는 다양한 금속의 전기 도금 및 정제에 유용하다.
전기 분해 기본 설정
전기 분해에는 음극과 양극이라고하는 두 개의 반대로 충전 된 극이 필요합니다. 음극은 음전하를 띤다. 그것은 양이온의 환원 부위이다. 양극은 양전하를 띤다. 그것은 음이온의 산화 부위이다. 전해조에서이 두 극은 외부 전원에 연결됩니다. 회로는 일반적으로 전해질이라는 염 용액에 의해 완성됩니다. 전기 분해를 통한 금속 제조에서, 금속 층이 캐소드 상에 형성 될 것이다.
반응의 본질
환원 산화 또는 산화 환원 반응에서 두 가지 원소가 전자를 교환합니다. 전해 공정에서, 양으로 하전 된 금속 이온이 전자를 얻어 중성 전하를 가질 때 고체 또는 용탕이 나타날 것이다. 양이온 성 금속 이온은 전해액에 존재한다. 이들은 전류가 장치에인가 될 때 캐소드 상에 고체 또는 용융 금속을 형성 할 수있다. 예를 들어, 알루미늄의 전해 정제에서, 전해질로부터의 알루미늄 이온은 캐소드에서 감소되어 매우 순수한 알루미늄을 형성 할 것이다.
전기의 응용
금속 생산이 이루어 지려면 전위가 적용되어야합니다. 전기 분해 과정에서 이러한 전자 흐름은 일반적으로 외부 DC 전류에서 발생합니다. 일단 전류가인가되면, 전자는 외부 회로를 통해 이동하고, 양이온은 전해질에서 이동합니다. 그런 다음 캐소드는 이들 전자 및 이온으로 환원되어 금속을 형성 할 수있다.
전기 도금의 끝점
전기 도금 공정은 전해액에서 양의 금속 이온의 양에 의해 제한된다. 이러한 모든 이온이 모두 사용되면 반응이 계속 될 수 없습니다. 따라서 더 이상 금속이 형성되지 않습니다. 더 많은 금속을 계속 형성하려면 전해액에 더 많은 양의 금속 이온을 추가해야합니다.