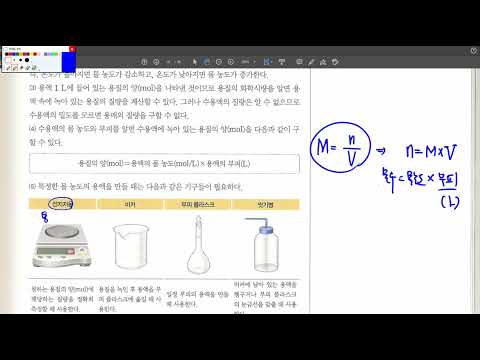
몰 농도 또는 몰 농도는 특정 용액에서 용질의 양을 측정 한 것이며 리터당 몰로보고됩니다. 에틸 알코올 또는 에탄올은 물과 결합하여 용액을 형성 할 수 있습니다. 이 용액의 몰 농도를 확인하기 위해 에틸 알코올의 양을 결정해야합니다. 고체 용질과 관련된 많은 몰 농도 문제와는 달리, 에탄올은 액체이며 물에 첨가되는 초기 양은 그램으로 표시되지 않습니다. 따라서 물의 용액에서 에탄올의 질량을 그램 단위로 결정하려면 에탄올의 다른 알려진 속성을 사용해야합니다.
비커 속의 특정 양의 에탄올을 측정하십시오. 예를 들어, 10 mL의 에탄올을 비이커에 붓습니다.
알려진 에탄올 밀도를 사용하여 측정 된 양의 에탄올 그램을 계산합니다. 에탄올에 대한 물질 안전 보건 자료 (MSDS)는 허용되는 에탄올 밀도를 0.790 g / cm ^ 3으로보고합니다. 밀도는 부피당 질량으로 표시되며 1 입방 센티미터는 1 밀리리터와 같습니다. 따라서 에탄올의 양은 그램 단위로 에탄올의 부피에 밀도를 곱하여 결정할 수 있습니다.
10 mL × 0.790 g / cm3 = 7.9 g의 에탄올
에탄올의 몰 질량을 결정하십시오. 몰 질량은 에탄올 분자의 각 개별 원자의 몰 질량의 합이며, 이는 2 개의 탄소, 6 개의 수소 및 1 개의 산소 원자로 구성된다. 에탄올의 몰 질량은 46 g / mol로 계산된다.
에탄올의 몰 수를 계산하기 위해 양을 그램 단위로 몰 질량으로 나눕니다. 7.9 g / 46 g / mol = 0.17 몰의 에탄올
에탄올에 물을 첨가하고 생성 된 용액의 부피를 측정한다. 예를 들어, 물과 에탄올이 결합하여 부피가 250mL 인 용액을 형성합니다.
밀리리터에서 리터로 환산 계수로 나눕니다. 예시적인 용액은 250 mL의 용액에 0.17 몰의 에탄올을 함유한다. 몰 농도는 리터당 몰로 표시되며 1L에 1000mL가 있습니다. 변환하려면 250ml를 1000ml / L로 나눕니다. 따라서 0.25L 당 0.17 몰이 있습니다.
리터당 몰 수로 몰 농도를 결정하십시오. 이전 단계는 0.25 리터의 용액 당 0.17 몰의 에탄올을 확인 하였다. 알 수없는 몰 수에 대한 비율을 설정하고 해결하면 1 리터의 용액 당 0.68 몰의 에탄올이 식별됩니다. 이로 인해 몰 농도는 0.68 mol / L 또는 0.68 M입니다.
0.17 몰 / 0.25 L = 엑스 mol / L
엑스 = 0.68 mol / L