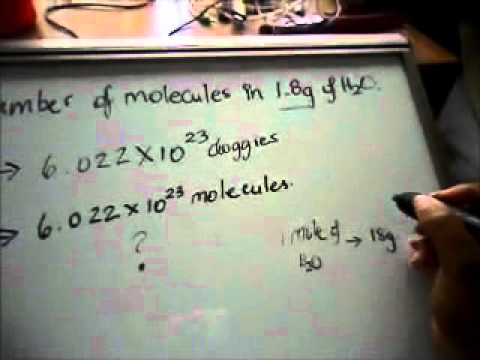
콘텐츠
화학에서, 몰은 화학량 론적 방정식에서 생성물과 반응물을 관련 시키는데 사용되는 양이다. 어떤 물질의 몰은 그 물질의 6.02 x 10 ^ 23 입자 (보통 원자 또는 분자)와 같습니다. 주어진 원소에 대하여, 1 몰의 질량 (그램)은 주기율표의 질량수로 주어진다. 분자의 "몰 질량"은 정확한 비율로 분자의 원소의 몰 질량의 합이다. 주기율표를 사용하여 원소와 분자의 몰 질량을 결정하고 그램과 몰을 변환하는 것은 간단합니다.
원소의 몰 질량 결정
- ••• 목성 이미지 /Photos.com/ 게티 이미지
주기율표에서 원소 리튬 (Li)을 찾으십시오. 리튬의 원자 번호는 3이며, 한 원자의 핵에있는 양성자의 수를 나타냅니다.
리튬의 질량 수는 6.94이며, 한 원자 핵의 양성자와 중성자 수의 합을 나타냅니다.
질량수는 1 몰의 리튬의 질량 (그램)과 동일하다. 이것은 리튬의 몰 질량입니다.
화합물의 분자 질량 결정

이산화탄소의 분자 질량을 결정하십시오 (화학식 CO2). 주기율표에서 탄소와 산소를 찾으십시오.
주기율표에서 각각 12.01과 16 인 탄소와 산소의 질량에 주목하십시오.
주기율표에서 1 개의 탄소 원자와 2 개의 산소 원자의 질량수를 더하십시오 : 12.01 + 2 (16) = 44.01 그램 / 몰
질량에서 몰로 변환
600 그램의 물 (H2O)에서 물의 몰수를 계산하십시오. 주기율표에서 수소와 산소를 찾으십시오.
그램을 몰과 관련하여 다음 방정식을 설정하십시오.
x 몰 H2O = (1 몰 H2O / 18 그램 H2O) x (600 그램 H2O)
600g의 H2O에 3.33 몰의 H2O가 있음을 찾기 위해 단계 2의 방정식을 풉니 다.