![[수질환경기사] 기초화학 특강 13 몰농도, 노말농도, 몰랄농도, 당량 - 고경미 교수님](https://i.ytimg.com/vi/fs812b8ddJI/hqdefault.jpg)
콘텐츠
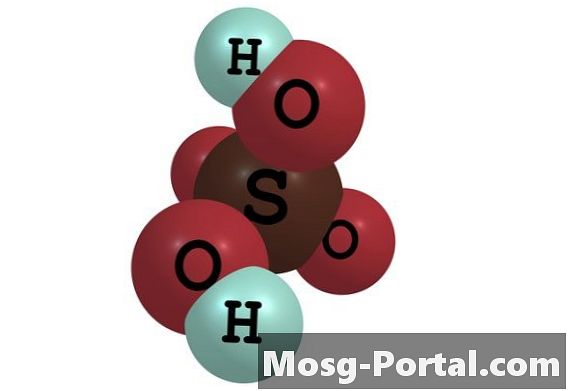
황산은 화학 물질의 산업 생산, 연구 작업 및 실험실 환경에서 일반적으로 사용되는 강력한 무기산입니다. 그것은 분자식 H2SO4를 갖는다. 그것은 모든 농도에서 물에 용해되어 황산 용액을 형성합니다. 용액에서, 1 몰의 황산은 음으로 하전 된 설페이트 이온 또는 SO4 (2-)의 몰과 2 몰의 양으로 하전 된 하이드로 늄 이온 또는 H3O +로 분리된다. 이들 이온의 농도는 용액 리터당 이온 몰수로 정의되는 몰 농도로 표현된다. 그들의 농도는 황산의 초기 농도에 달려 있습니다.